El model de Thomson és un model de l'àtom proposat en l'any 1904 per Joseph John Thomson. Aquest nou model atòmic va ser una evolució del model atòmic de Dalton.
Aquesta nova teoria atòmica de Thomson va intentar explicar dues propietats llavors conegudes dels àtoms:
-
Els electrons són partícules carregades negativament.
-
Els àtoms no tenen càrrega elèctrica neutra.
Per què també es coneix com el model de l'àtom de púding?
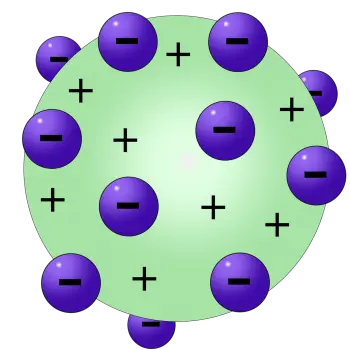
El model de Thomson s'ha comparat (però no ell mateix) amb unes postres britànic: el púding de panses, d'aquí el nom d'aquest model.
El model del púding de panses té electrons envoltats per un volum de càrrega positiva, molt semblant a "passes" carregades negativament incrustades en un "púding" carregat positivament.
Característiques del model atòmic de Thomson
Les principals característiques del model atòmic de Thomson es resumeixen en aquests 4 punts:
-
Thomson va descobrir els electrons a través dels seus experiments amb tubs de raigs catòdics.
-
En el seu model d'àtom està format per electrons de càrrega negativa incrustats en una esfera de càrrega positiva com en un "púding de panses".
-
Els electrons estan repartits de manera uniforme per tot l'àtom.
-
L'àtom és neutre de manera que les càrregues negatives dels electrons es compensen amb la càrrega positiva.
En què consisteix el model atòmic de Thomson?
Segons el model atòmic de Thomson, l'àtom consisteix en electrons són a una "sopa" carregada positivament, que compensa les càrregues elèctricament negatives dels electrons.
Segons aquest model, els electrons podrien girar lliurement en una gota o núvol d'una substància tan carregada positivament. Les seves òrbites es van estabilitzar dins de l'àtom pel fet que quan un electró s'allunya de centre d'un núvol carregada positivament, experimenta un augment en la força d'atracció cap al centre del núvol.
Aquesta força d'atracció el torna de nou a el centre. La força d'atracció a centre d'un núvol esfèrica carregada uniformement és directament proporcional a la distància al seu centre.
En el model de Thomson, els electrons poden rotar lliurement en òrbites d'anells, que s'estabilitzen mitjançant interaccions entre electrons. Els espectres de línia s'explicaven per la diferència d'energies quan es movien al llarg de diferents òrbites d'anells.
El model de Thomson va esdevenir un precursor del posterior model atòmic de Bohr, que representa l'àtom com una semblança del sistema solar.
Limitacions del model atòmic de Thomson
El model de l'àtom de Thomson va ser refutat en un experiment sobre la dispersió de partícules alfa en una làmina d'or en 1909, que va ser analitzat per Ernest Rutherford en 1911. L'experiment de Rutherford suggeria que l'àtom tenia un nucli molt petit que conté una gran càrrega positiva.
En 1913, Henry Moseley va demostrar experimentalment que la càrrega nuclear a càrregues elementals està molt a prop del nombre atòmic.
Aquest treball finalment va conduir a la creació en el mateix any del model de Bohr, similar a el sistema solar. Segons aquest model, el nucli té una càrrega positiva igual a el nombre atòmic i està envoltat per un nombre igual d'electrons en capes orbitals.
El problema de Thomson
Al considerar el model de Thomson, es va formular un problema de física matemàtica encara sense resoldre - trobar la configuració de moltes càrregues amb l'energia potencial més baixa en una esfera - el problema de Thomson.


