
L'àtom és una estructura en què s'organitza la matèria al món físic oa la natura. La seva estructura està composta per diferents combinacions de tres subpartícules: els neutrons, els protons i els electrons.
Definició d'àtom: “És la partícula més petita de què pot estar constituït un element i mitjançant la seva combinació es formen les molècules”.
Aquesta definició prové del grec, que vol dir indivisible. En el moment que es van batejar aquestes partícules, es creia que efectivament no es podien dividir.
Estructura i parts d'un àtom
L'àtom, segons el model atòmic actual, està dividit en dues parts:
-
El nucli: aquesta part està formada per neutrons i protons.
-
L'escorça: formada únicament per electrons.
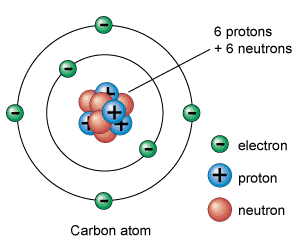
Partícules subatòmiques: protons, neutrons i electrons
Els protons, neutrons i electrons són les partícules subatòmiques que formen els àtoms. La forma com s'organitzen entre elles és allò que defineix cada element químic.
Els electrons són les partícules subatòmiques més lleugeres i tenen una càrrega elèctrica negativa. Els protons tenen càrrega positiva i pesen unes 1.836 vegades més que els electrons. Finalment, els neutrons no tenen càrrega elèctrica i pesen aproximadament el mateix que els protons.
Els protons i neutrons es troben agrupats al nucli atòmic (per això també s'anomenen nucleons) gràcies a unes forces nuclears que els mantenen units. Per tant, el nucli atòmic té una càrrega positiva (la dels protons) en què es concentra gairebé tota la seva massa.
Per altra banda, al voltant del nucli hi ha un cert nombre delectrons, carregats negativament. La càrrega total del nucli (positiva) és igual a la càrrega negativa dels electrons, de manera que la càrrega elèctrica total és neutra.
Com es va descobrir el model atòmic actual?
Abans d'arribar als coneixements actuals sobre l'estructura de l'àtom, al llarg de la història s'han desenvolupat diferents teories atòmiques sobre la composició de la matèria.
A partir de les teories atòmiques, els científics han anat presentant uns models atòmics que de mica en mica han anat evolucionant.
El primer model que va presentar John Dalton ha anat evolucionant fins a arribar al model atòmic de Niels Bohr. Bohr presentava un model molt semblant a l'actual amb els electrons girant al voltant del nucli.
Característiques dels àtoms
Segons la composició dels àtoms es diferencien els diferents elements químics representats a la taula periòdica dels elements químics.
 Les propietats que defineixen els àtoms són:
Les propietats que defineixen els àtoms són:
-
El nombre atòmic (Z) que indica la quantitat de protons al nucli. Tots els àtoms amb un mateix nombre de protons pertanyen al mateix element. Per exemple, els que tenen un sol protó són àtoms d'hidrogen.
-
El nombre màssic fa referència a la suma de protons i neutrons. Els elements amb diferent nombre de neutrons pertanyen a isòtops diferents del mateix element.
-
L'electronegativitat és la tendència que té un àtom per atraure electrons en formar un enllaç químic.
-
El radi atòmic correspon a la meitat de la distància entre dos nuclis dun mateix element enllaçats entre si.
-
El potencial dʻionització és lʻenergia necessària per separar un electró de lʻelement.
Relació dels àtoms amb les molècules
Una molècula es forma quan dos o més àtoms s'uneixen mitjançant enllaços químics. Els àtoms es poden unir entre si mitjançant enllaços. Aquests enllaços es formen quan els àtoms comparteixen, guanyen o perden electrons per aconseguir una configuració electrònica més estable.
En una molècula, els àtoms estan disposats en una estructura tridimensional i es mantenen units pels enllaços químics. La manera com s'uneixen els àtoms en una molècula en determina les propietats químiques i físiques, així com el comportament en les reaccions químiques.
D'on prové l'energia dels àtoms?
L'energia dels àtoms prové principalment de dues fonts:
- l'energia nuclear
- l'energia electrònica.
Energia nuclear
L'energia nuclear està relacionada amb les forces que mantenen units els nuclis atòmics. L'energia nuclear s'allibera o absorbeix durant els processos nuclears, com la fissió nuclear i la fusió nuclear. A la fissió nuclear, es divideix un nucli pesant en nuclis més petits, ia la fusió nuclear, s'uneixen dos nuclis lleugers per formar-ne un de més pesat. Ambdós processos alliberen energia a causa de les diferències a les masses dels nuclis involucrats, segons la famosa equació d'Einstein, E = mc².
Energia electrònica
Per la seva banda, l'energia electrònica està associada amb la configuració dels electrons en els àtoms. Els electrons orbiten al voltant del nucli atòmic en nivells denergia o capes electròniques.
Els electrons es poden moure entre aquests nivells denergia mitjançant labsorció o emissió denergia en forma de fotons. Quan els electrons absorbeixen energia, poden saltar a nivells més alts. Quan alliberen energia, tornen a nivells més baixos d'energia.
Aquests canvis d'energia electrònica són responsables de l'emissió i l'absorció de llum, així com d'altres formes de radiació electromagnètica, com ara els raigs X.
