
Els elements químics són les unitats bàsiques de la matèria. Estan formats per àtoms que contenen un nombre específic de protons al seu nucli, conegut com a nombre atòmic Aquest nombre és únic per a cada element i defineix les seves propietats químiques i físiques.
Els elements s'agrupen a la taula periòdica, que organitza aquests elements segons les seves característiques i els seus comportaments. A més, es poden combinar entre si a través de reaccions químiques per formar compostos amb noves propietats, com passa quan l'oxigen i l'hidrogen es combinen per formar aigua.
Definició d'element químic
 Un element químic és una substància pura composta per àtoms que tenen el mateix nombre de protons al seu nucli, conegut com a nombre atòmic. Aquest número distingeix cada element i és la característica que el defineix.
Un element químic és una substància pura composta per àtoms que tenen el mateix nombre de protons al seu nucli, conegut com a nombre atòmic. Aquest número distingeix cada element i és la característica que el defineix.
El terme "espècie química" també s'utilitza per referir-se a un àtom, encara que també pot fer referència a molècules, ions i altres substàncies.
Cada element té un símbol químic, compost per una o dues lletres, i un nom que generalment prové del llatí. Aquests símbols i noms estan regulats per la IUPAC i es troben reflectits a la taula periòdica de Mendeleev.
Elements i substàncies simples
Quan els elements químics existeixen de manera aïllada, se'ls coneix com a substàncies simples.
És important distingir entre els elements químics, que són entitats abstractes descrites per les seves característiques, i els objectes materials, que són les substàncies que realment hi ha a la natura. Aquestes darreres poden ser compostos químics simples amb propietats físiques i químiques ben definides.
Gasos nobles
Dins dels elements químics, un grup particular són els gasos nobles.
Aquests elements comparteixen propietats molt similars: són gasos monoatòmics, incolors, inodors i tenen una reactivitat química extremadament baixa. Exemples de gasos nobles inclouen heli, neó i argó.
Combinació d'elements
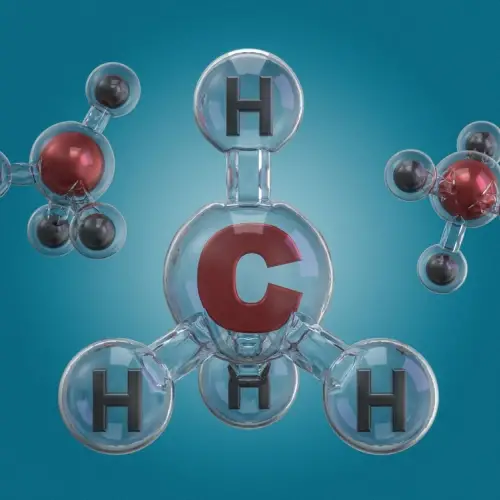 Els elements químics poden reaccionar entre si per formar nous compostos, un procés que es dóna a les reaccions químiques.
Els elements químics poden reaccionar entre si per formar nous compostos, un procés que es dóna a les reaccions químiques.
Per exemple, l'oxigen i l'hidrogen, dos elements gasosos, es poden combinar per formar aigua, un compost amb propietats completament diferents de les dels seus elements constituents.
¿ Quants són els elements químics?
Es coneixen 118 elements químics, dels quals 94 es troben a la natura (alguns només en petites quantitats). Els 24 restants s'obtenen artificialment com a resultat de reaccions nuclears. Aquests elements són fonamentals en la investigació científica i en diverses aplicacions tecnològiques.
Isòtops
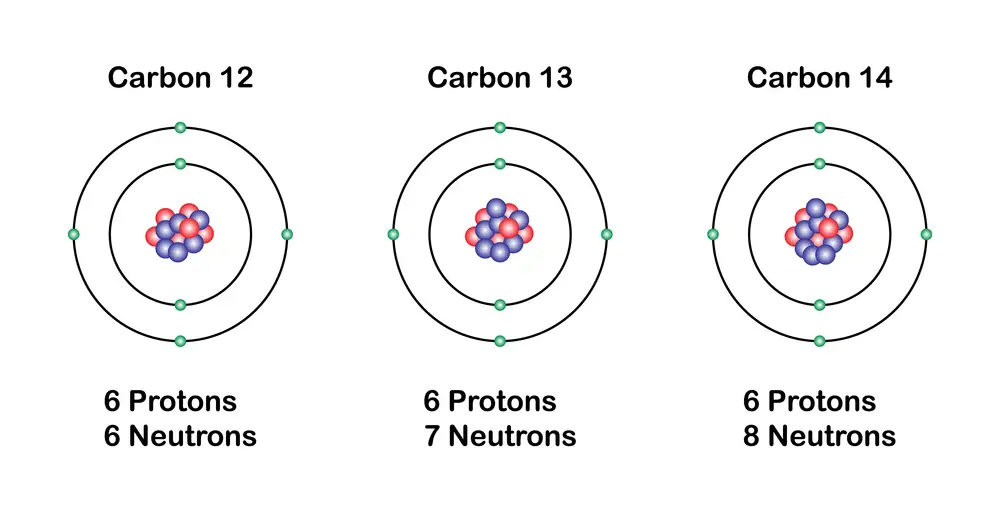 Un aspecte important dels elements és l‟existència d‟isòtops, que són variants d‟un mateix element químic.
Un aspecte important dels elements és l‟existència d‟isòtops, que són variants d‟un mateix element químic.
Els isòtops tenen el mateix nombre de protons però un nombre diferent de neutrons. Això fa que tinguin masses atòmiques diferents. Tot i que els isòtops d'un element tenen propietats químiques similars, les propietats físiques (com l'estabilitat i la radioactivitat) poden variar considerablement.
Per exemple, el carboni té dos isòtops estables, el carboni-12 i el carboni-13, i un isòtop radioactiu, el carboni-14, que és utilitzat en datació arqueològica.
Isòtops a la indústria nuclear
Alguns isòtops són fonamentals en aplicacions nuclears, especialment en reactors nuclears . A continuació et mostro els més importants:
- Urani-235 (U-235) : És un dels isòtops més importants en els reactors nuclears. La seva capacitat per fissionar-se en ser bombardejat amb neutrons el converteix en un combustible crucial per a la generació denergia nuclear. L'Urani-235 es troba en concentracions molt petites a la natura, per la qual cosa ha de ser enriquit per ser utilitzat en reactors.
- Plutoni-239 (Pu-239) Aquest isòtop es produeix en els reactors nuclears a partir d'Urani-238. Quan l'Urani-238 absorbeix un neutró, es converteix en Plutoni-239, el qual també és fissionable i pot ser utilitzat com a combustible als reactors nuclears.
- Deuteri (H-2) : Un isòtop de l'hidrogen que es troba a l'aigua i és utilitzat en els reactors de fissió nuclear. El Deuteri, juntament amb el triti (H-3), s'utilitza als reactors de fusió experimental, on els isòtops d'hidrogen es fusionen per alliberar energia.
- Triti (H-3) Encara que és radioactiu i té una vida mitjana curta, el Triti és un isòtop utilitzat en certs tipus de reactors nuclears de fusió. Aquest isòtop es produeix artificialment i es fa servir en experiments de fusió nuclear, com els realitzats en els reactors de fusió ITER.
Classificació dels elements
Els elements químics es classifiquen en metalls, no metalls i metal·loides, depenent de les seves propietats.
Els metalls, que constitueixen la majoria dels elements, són bons conductors delectricitat i calor, mentre que els no metalls tendeixen a ser aïllants. Els metal·loides, per la seva banda, tenen propietats intermèdies entre els metalls i no metalls.
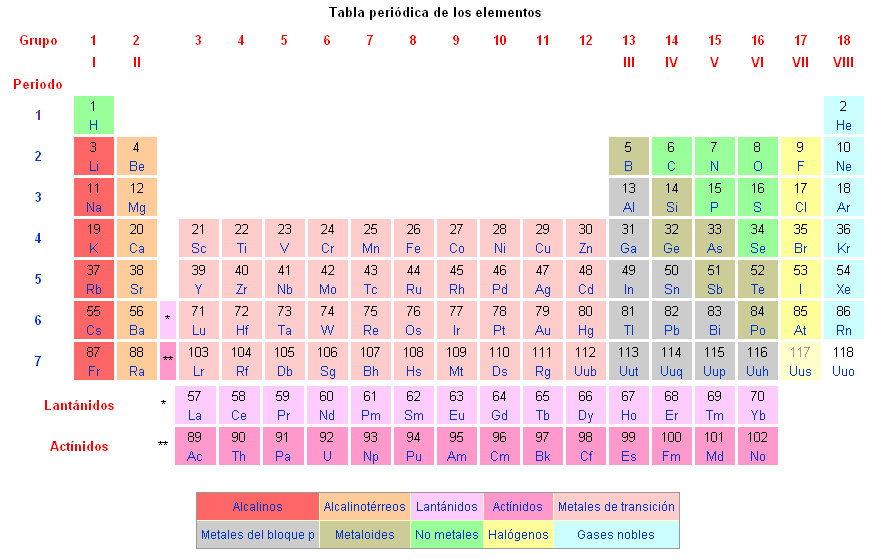
A la taula periòdica, els elements es disposen en files anomenades períodes i en columnes anomenades grups. Els elements del mateix grup comparteixen propietats químiques similars.
De què depèn el nom dels elements?
El dret a proposar un nom per a un nou element químic el tenen els descobridors del mateix.
Tot i això, aquest nom ha de complir certes regles. Després de la publicació d'un nou descobriment, l'existència ha de ser verificada per laboratoris independents. Si es confirma, la IUPAC aprova oficialment el nom del nou element.
Actualment, els 118 elements coneguts tenen noms permanents aprovats per la IUPAC, i abans que s'aprovi el nom definitiu, s'utilitzen noms temporals basats en el número atòmic.
Classificació dels elements a la taula periòdica
Els elements químics es troben classificats a la taula periòdica dels elements.
Els elements químics coneguts són els següents:
|
Element químic |
Símbol |
Número atòmic (Z) |
Pes atòmic (u) |
|
Hidrogen |
H |
1 |
1.0079 |
|
Heli |
He |
2 |
4.0026 |
|
Liti |
Li |
3 |
6941 |
|
Beril·li |
Be |
4 |
9.0122 |
|
Boro |
B |
5 |
10811 |
|
Carboni |
C |
6 |
12.0107 |
|
Nitrogen |
N |
7 |
14.0067 |
|
Oxigen |
O |
8 |
15.9994 |
|
Fluor |
F |
9 |
18.9984 |
|
Neó |
Ne |
10 |
20.1797 |
|
Sodi |
Na |
11 |
22.9897 |
|
Magnesi |
Mg |
12 |
24305 |
|
Alumini |
Al |
13 |
26.9815 |
|
Silici |
Si |
14 |
28.0855 |
|
Fòsfor |
P |
15 |
30.9738 |
|
Sofre |
S |
16 |
32065 |
|
Clor |
Cl |
17 |
35453 |
|
Argó |
Ar |
18 |
39948 |
|
Potassi |
K |
19 |
39.0983 |
|
Calci |
Ca |
20 |
40078 |
|
Escandi |
Sc |
21 |
44.9559 |
|
Titani |
Tu |
22 |
47867 |
|
Vanadi |
V |
23 |
50.9415 |
|
Crom |
Cr |
24 |
51.9961 |
|
Manganès |
Mn |
25 |
54938 |
|
Ferro |
Fe |
26 |
55845 |
|
Cobalt |
Co |
27 |
58.9332 |
|
Níquel |
Ni |
28 |
58.6934 |
|
Coure |
Cu |
29 |
63546 |
|
Zinc |
Zn |
30 |
65.39 |
|
Gal·li |
Ga |
31 |
69723 |
|
Germani |
Ge |
32 |
72.64 |
|
Arsènic |
As |
33 |
74.9216 |
|
Seleni |
Es |
34 |
78,96 |
|
Brom |
Br |
35 |
79904 |
|
Kriptó |
Kr |
36 |
83.8 |
|
Rubidi |
Rb |
37 |
85.4678 |
|
Estronci |
Sr. |
38 |
87.62 |
|
Itri |
I |
39 |
88.9059 |
|
Zirconi |
Zr |
40 |
91224 |
|
Niobi |
Nb |
41 |
92.9064 |
|
Molibdè |
Mo |
42 |
95.94 |
|
Tecneci |
Tc |
43 |
98 |
|
Ruteni |
Ru |
44 |
101.07 |
|
Rodi |
Rh |
45 |
102.9055 |
|
Paladi |
Pd |
46 |
106.42 |
|
Plata |
Ag |
47 |
107.8682 |
|
Cadmi |
Cd |
48 |
112411 |
|
Indi |
In |
49 |
114818 |
|
Estany |
Sn |
50 |
118.71 |
|
Antimoni |
Sb |
51 |
121.76 |
|
Telur |
Et |
52 |
127.6 |
|
Iode |
I |
53 |
126.9045 |
|
Xenó |
Xe |
54 |
131293 |
|
Cessi |
Cs |
55 |
132.9055 |
|
Bari |
Ba |
56 |
137327 |
|
Lantano |
La |
57 |
138.9055 |
|
Ceri |
Ce |
58 |
140116 |
|
Praseodimi |
Pr |
59 |
140.9077 |
|
Neodimi |
Nd |
60 |
144.24 |
|
Prometio |
Pm |
61 |
145 |
|
Samari |
Sm |
62 |
150.36 |
|
Europi |
Eu |
63 |
151964 |
|
Gadolini |
Gd |
64 |
157.25 |
|
Terbi |
Tb |
65 |
158.9253 |
|
Disprosi |
Dy |
66 |
162.5 |
|
Holmi |
Ho |
67 |
164.9303 |
|
Erbi |
Er |
68 |
167259 |
|
Tuli |
Tm |
69 |
168.9342 |
|
Iterbi |
ib |
70 |
173.04 |
|
Lutecio |
Lu |
71 |
174967 |
|
Hafni |
Hf |
72 |
178.49 |
|
Tantali |
Ta |
73 |
180.9479 |
|
Wolframi |
W |
74 |
183.84 |
|
Reni |
Re |
75 |
186207 |
|
Osmi |
Us |
76 |
190.23 |
|
Iridi |
Anar |
77 |
192217 |
|
Platí |
Pt |
78 |
195078 |
|
Or |
Au |
79 |
196.9665 |
|
Mercuri |
Hg |
80 |
200.59 |
|
Tali |
Tl |
81 |
204.3833 |
|
Plom |
Pb |
82 |
207.2 |
|
Bismut |
Bi |
83 |
208.9804 |
|
Poloni |
Po |
84 |
209 |
|
Àstat |
At |
85 |
210 |
|
Radó |
Rn |
86 |
222 |
|
Francio |
Fr |
87 |
223 |
|
Ràdio |
Ra |
88 |
226 |
|
Actini |
Ac |
89 |
227 |
|
Torio |
Th |
90 |
232.0381 |
|
Protactini |
Pa |
91 |
231.0359 |
|
Urani |
U |
92 |
238.0289 |
|
Neptuni |
Np |
93 |
237 |
|
Plutoni |
Pu |
94 |
244 |
|
Americi |
Am |
95 |
243 |
|
Curi |
Cm |
96 |
247 |
|
Berkelio |
Bk |
97 |
247 |
|
Californi |
Cf |
98 |
251 |
|
Einsteni |
És |
99 |
252 |
|
Fermi |
Fm |
100 |
257 |
|
Mendelevi |
Md |
101 |
258 |
|
Nobeli |
No |
102 |
259 |
|
Laurenci |
Lr |
103 |
262 |
|
Rutherfordio |
Rf |
104 |
261 |
|
Dubni |
Db |
105 |
262 |
|
Seaborgi |
Sg |
106 |
266 |
|
Bohri |
Bh |
107 |
264 |
|
Hassio |
Hs |
108 |
277 |
|
Meitneri |
Mt |
109 |
268 |
|
Darmstadtio |
Ds |
110 |
281 |
|
Roentgeni |
Rg |
111 |
272 |
|
Copernici |
Cn |
112 |
285 |
|
Nihoni |
Nh |
113 |
286 |
|
Flerovio |
Fl |
114 |
289 |
|
Moscovi |
Mc |
115 |
288 |
|
Livermori |
Lv |
116 |
292 |
|
Teneso |
Ts |
117 |
294 |
|
Oganesó |
Og |
118 |
294 |
Representació d´un element químic
Els símbols d'elements químics es fan servir com a abreviatures per al nom dels elements. Com a símbol, generalment prenen la lletra inicial del nom de l'element i, si cal, afegeixen la següent o una de les següents. En general, aquestes són les lletres inicials dels noms llatins dels elements.
 Aquest sistema de símbols químics va ser proposat el 1814 pel químic suec J. Berzelius. Els elements utilitzats abans de l'aprovació oficial dels seus noms i símbols permanents consisteixen en tres lletres, cosa que significa que els noms llatins dels tres dígits a la notació decimal del seu nombre atòmic. També es fa servir el sistema de notació per a homòlegs superiors descrits anteriorment (Eka-Rn, Eka-Pb, etc.).
Aquest sistema de símbols químics va ser proposat el 1814 pel químic suec J. Berzelius. Els elements utilitzats abans de l'aprovació oficial dels seus noms i símbols permanents consisteixen en tres lletres, cosa que significa que els noms llatins dels tres dígits a la notació decimal del seu nombre atòmic. També es fa servir el sistema de notació per a homòlegs superiors descrits anteriorment (Eka-Rn, Eka-Pb, etc.).
Els números més petits al costat del símbol de l'element indiquen:
-
La massa atòmica a la part superior esquerra.
-
Número atòmic a la part inferior esquerra.
