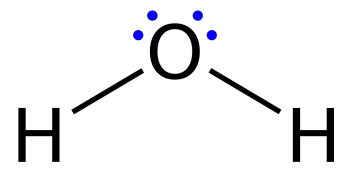
Les estructures de Lewis, també anomenada diagrama de punt o model de Lewis, són diagrames que mostren l'enllaç entre els àtoms d'una molècula juntament amb els parells d'electrons existents. Es pot dibuixar una estructura de Lewis per a cada molècula enllaçada covalentment, així com per a compostos de coordinació.
Les estructures de Lewis reben el seu nom de Gilbert Newton Lewis , que les va introduir el 1916.
Són similars els diagrames utilitzats per representar una configuració electrònica de punts on els electrons de valència en parells solitaris estan representats per punts, però també poden contenir línies que representen parells compartits en un enllaç químic (simple, doble, triple, etc.).
Les línies es dibuixen entre àtoms enllaçats entre si (es poden utilitzar també parells de punts). Els electrons en excés que formen parells solitaris estan representats per parells de punts col·locats al costat dels àtoms.
Per què serveix l'estructura de Lewis?
Una estructura de Lewis és una representació gràfica que mostra la geometria molecular dun compost, els enllaços que es formen entre les molècules i la distància entre ells. És a dir, aquestes estructures mostren cada àtom i la seva posició a l'estructura de la molècula utilitzant el seu símbol químic.
Els models de Lewis serveixen per representar la quantitat delectrons de valència dun element que interactua amb altres elements químics de la mateixa o una altra espècie formant enllaços.
Com es construeix un diagrama de punts de Lewis?
Per representar l'estructura de Lewis d'una molècula cal presentar un àtom central. Els altres elements que constitueixen la molècula es representen envoltant l'àtom central.
L'àtom central en tant que sigui possible ha de ser el menys electronegatiu, per exemple el carboni. Per altra banda, l'hidrogen sempre es representa com un àtom terminal.
La regla de l'octet
La regla de l'octet és una regla que estableix que els àtoms s'enllaçen entre ells amb l'objectiu de completar la darrera capa de la configuració electrònica.
Aquesta regla determina que els àtoms estables tenen vuit electrons a la seva capa de valència.
Per poder aconseguir aquesta estabilitat, cada àtom necessita compartir, perdre o guanyar electrons als enllaços químics que forma fins a tenir els vuit electrons requerits a la capa de valència.
En dibuixar un diagrama evitarem assignar més de vuit electrons a cada element perquè cada enllaç covalent simple aporta dos electrons a cada àtom de la unió.
Electrons de valència
El nombre total d'electrons representats al model de Lewis correspon a la suma dels números dels electrons de valència de cada àtom individual. Per contra, els electrons solitaris que no són de valència no s'hi representen.
La valència que es representa a l'estructura de Lewis és el nombre d'electrons a l'últim nivell d'energia de cada element químic en fer-ne la configuració electrònica.
Un cop determinats els electrons de valència s'han d'ubicar al diagrama. A continuació, quan s'han col·locat tots els parells d'electrons solitaris, pot ser que els àtoms no compleixin la regla de l'octet.
Tots els àtoms de diagrama han de quedar enllaçats. En una estructura de Lewis, considerem que un parell delectrons formen un enllaç entre dos àtoms. De la mateixa manera que considerem que dos àtoms comparteixen el mateix parell de l'enllaç, l'àtom que originalment tenia el parell solitari continua tenint un octet.
