La massa molar és una propietat física que sutilitza per descriure la massa mitjana dun àtom o molècula duna substància en unitats de grams per mol (g/mol) i es representa amb la lletra "M".
En altres paraules, la massa molar indica quants grams duna substància hi ha en un mol daquesta substància. El mol és una unitat de quantitat de substància al Sistema Internacional d'Unitats (SI).
Unitats de mesura
Al Sistema Internacional d'Unitats (SI), la unitat per mesurar la massa molar és quilogram per mol (kg/mol). Tot i això, quan la massa molar s'expressa en g/mol, el seu valor numèric és el mateix amb el pes molecular relatiu. Per això, històricament el pes molar s'expressa generalment en grams per mol (g/mol).
La massa molar a les fórmules generalment s'indica amb una lletra majúscula M.
Les comparacions directes i els mesuraments de les masses d‟àtoms i molècules es realitzen utilitzant mètodes d‟espectrometria de masses.
Càlcul de la massa molar
El càlcul de la massa molar d'un compost es fa sumant les masses de tots els àtoms en una molècula utilitzant les masses atòmiques relatives.
Les masses atòmiques relatives són nombres que representen la massa d'un àtom en relació amb la massa de l'àtom de carboni-12, que es defineix com a 12 unitats de massa atòmica (uma).
Per exemple, la massa atòmica relativa de l'hidrogen és aproximadament 1 uma, mentre que la massa atòmica relativa de l'oxigen és aproximadament 16 uma.
Molècules complexes
 Per calcular el nombre de les masses molars de molècules complexes es pot determinar sumant les masses molars dels elements constituents. Per exemple, la massa molar d'aigua H 2 O hi ha
Per calcular el nombre de les masses molars de molècules complexes es pot determinar sumant les masses molars dels elements constituents. Per exemple, la massa molar d'aigua H 2 O hi ha
M(H 2 O) = 2 M(H) + M(O) = 2.1 g/mol + 16 g/mol = 18.1 g/mol
Com calcular la massa molar pas a pas?
El càlcul de la massa molar d'una substància química es pot fer seguint aquests passos:
-
Identificar la fórmula química del compost químic.
-
Determinar quants àtoms de cada element hi ha a la fórmula química.
-
Multiplicar el nombre d'àtoms de cada element per la massa atòmica relativa.
-
Sumar les masses de tots els àtoms a la fórmula per obtenir la massa molar.
Exemple pràctic
Vegem-ne un exemple concret per calcular la massa molar de l'aigua (H₂O):
-
La fórmula química de l'aigua és H₂O, cosa que significa que conté dos àtoms d'hidrogen (H) i un àtom d'oxigen (O).
-
La massa atòmica relativa de l'hidrogen és aproximadament 1 uma i la de l'oxigen és aproximadament 16 uma.
-
Per calcular la massa molar de l'aigua, sumem les masses dels àtoms: (2 * 1 uma) + (1 * 16 uma) = 2 uma + 16 uma = 18 uma.
Per tant, la massa molar de laigua és de 18 g/mol.
Exemples
A continuació, es presenta una taula amb exemples d'algunes masses molars de substàncies diferents:
|
substància |
Fórmula química |
Massa molar (g/mol) |
Descripció |
|
Hidrogen |
H₂ |
2 |
L´hidrogen és l´element més lleuger, amb una massa molar de 2 g/mol. |
|
Oxigen |
O₂ |
32 |
L'oxigen és essencial per a la respiració i té una massa molar de 32 g/mol. |
|
Diòxid de Carboni |
CO₂ |
44 |
El CO₂ és un gas amb efecte d'hivernacle amb una massa molar de 44 g/mol. |
|
Amoníac |
NH₃ |
17 |
L'amoníac s'utilitza a la indústria química i té una massa molar de 17 g/mol. |
|
Metà |
CH₄ |
16 |
El metà és el component principal del gas natural i té una massa molar de 16 g/mol. |
|
Àcid Sulfúric |
H₂SO₄ |
98 |
L'àcid sulfúric és un àcid fort àmpliament utilitzat amb una massa molar de 98 g/mol. |
|
Glucosa |
C₆H₁₂O₆ |
180 |
La glucosa és un sucre que es troba en aliments i té una massa molar de 180 g/mol. |
|
Clorur de Sodi (sal de taula) |
NaCl |
58.5 |
El clorur de sodi és la sal de taula comuna i té una massa molar de 58,5 g/mol. |
|
Urani |
U |
238.03 |
L'urani és un element utilitzat com a combustible en reactors nuclears. |
|
Plutoni |
Pu |
244 |
El plutoni és un element utilitzat en armes nuclears i reactors nuclears. |
|
Aigua Pesada |
D₂O |
20.03 |
L'aigua pesada conté deuteri en lloc d'hidrogen i es fa servir en reactors nuclears. |
|
Urani Enriquit |
U-235 |
Varia |
L'urani enriquit conté una proporció més gran d'U-235 i és essencial per a la fissió nuclear. |
Per què serveix la massa molar?
La massa molar és una propietat fonamental que té diverses implicacions i aplicacions a la química i altres disciplines científiques.
Algunes de les aplicacions més destacades inclouen:
-
Conversió entre mols i grams: es fa servir per convertir entre la quantitat de substància en mols i la massa en grams d'una substància.
-
Determinació de la composició de les substàncies.
-
Càlcul de reaccions químiques: és essencial per calcular les quantitats de reactants i productes en una reacció química, cosa que permet l'estequiometria i la planificació d'experiments.
-
Identificació de substàncies desconegudes: s'utilitza en tècniques analítiques, com l'espectroscòpia de masses, per identificar substàncies desconegudes a través de la comparació de les masses molars experimentals amb les masses molars calculades.
-
Aplicacions en termodinàmica: a la termodinàmica química s'utilitza per calcular propietats com l'entalpia i l'entropia de reaccions químiques.
Importància de la vida quotidiana
La massa molar no només és important al laboratori, sinó que també té aplicacions a la vida quotidiana. Alguns exemples inclouen:
-
Nutrició : a la indústria alimentària, s'utilitza per calcular la quantitat de nutrients en els aliments i per establir les recomanacions de consum diari de nutrients essencials com proteïnes, carbohidrats i greixos.
-
Farmacologia : en la formulació de medicaments, és crucial conèixer la massa molar dels components actius i els excipients per garantir la dosificació adequada i l'eficàcia del medicament.
-
Energia : a la indústria energètica, la massa molar s'utilitza en la producció i l'ús de combustibles i energia renovable, com el càlcul de la densitat dels combustibles i l'eficiència de les cel·les de combustible.
Relació amb la taula periòdica
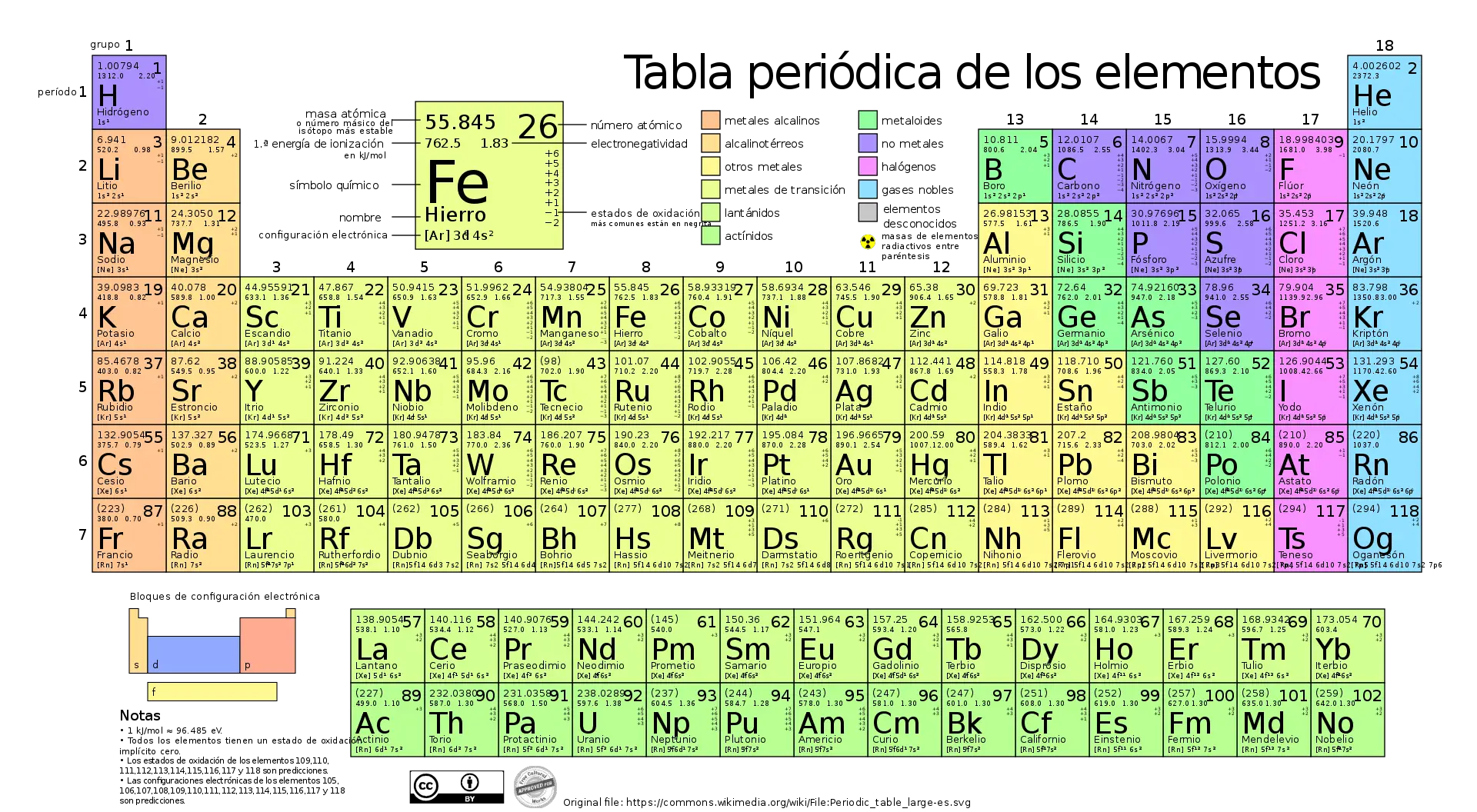 La taula periòdica dels elements químics és una eina inavaluable per determinar les masses molars d'elements i de compostos. Cada element a la taula periòdica té una massa atòmica relativa que s'arrodoneix a nombres enters o fraccions simples en el cas d'isòtops.
La taula periòdica dels elements químics és una eina inavaluable per determinar les masses molars d'elements i de compostos. Cada element a la taula periòdica té una massa atòmica relativa que s'arrodoneix a nombres enters o fraccions simples en el cas d'isòtops.
Per calcular la massa molar d'un compost, simplement se sumen les masses atòmiques relatives dels elements presents, multiplicades pel nombre d'àtoms de cada element a la fórmula.
Exemple del clorur de sodi
Un exemple interessant és calcular la massa molar del clorur de sodi (NaCl).
El sodi (Na) té una massa atòmica relativa d'aproximadament 23 uma i el clor (Cl) té una massa atòmica relativa d'aproximadament 35.5 uma.
Per tant, la massa molar del NaCl és la suma d‟aquestes masses atòmiques: 23 uma + 35.5 uma = 58.5 uma, que és equivalent a 58.5 g/mol.
No confondre amb...
La massa molar sol confondre's amb altres conceptes en química i física pel fet que tots estan relacionats amb el pes o la quantitat de substància. Aquí hi ha alguns conceptes amb què comunament es confon:
- Massa molecular : La massa molecular és la suma de les masses atòmiques dels àtoms en una molècula, igual que la massa molar, però expressada en unitats de massa atòmica (uma ou) , no en g/mol. La massa molar i la massa molecular tenen el mateix valor numèric, però es diferencien en les unitats i en el context en què es fan servir.
- Massa atòmica Aquesta és la mitjana de la massa dels àtoms d'un element, tenint en compte l'abundància dels seus isòtops, i es mesura en unitats de massa atòmica (u). La massa atòmica es fa servir per calcular la massa molar d'un element en el context d'una substància.
- Pes molecular Aquest terme antigament s'usava com a sinònim de massa molecular, però no és correcte. El pes és una força (resultat de la gravetat actuant sobre una massa) i es mesura a newtons (N), mentre que la massa molecular és una mesura de la quantitat de matèria en unitats de massa atòmica. És més correcte parlar de massa molecular que no pas de pes molecular.
- Quantitat de substància (mol) : De vegades es confon amb la massa molar perquè ambdós conceptes involucren el mol. Tot i això, la quantitat de substància (mol) és una mesura de la quantitat de partícules (àtoms, molècules, ions) en una mostra i no de la seva massa. La massa molar, en canvi, representa la massa dun mol daquestes partícules.
- Volum molar : Aquest concepte fa referència al volum que ocupa un mol d'una substància, especialment en el context de gasos, i sol expressar-se en L/mol. És diferent de la massa molar, que mesura la quantitat de massa en grams per cada mol de substància.
