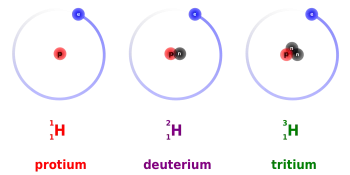
El triti i el deuteri són dos dels tres isòtops d'hidrogen que s'utilitzen com a combustible a les reaccions nuclears de fusió. L'hidrogen té tres isòtops: protio, deuteri i triti.
Una reacció de fusió nuclear consisteix en la unió de dos nuclis lleugers (àtoms d'hidrogen) per formar-ne un de sol. Això passa quan els nuclis s'acosten tant que les forces nuclears entre ells es tornen molt fortes.
Aquest tipus denergia està en fase destudi i pretén ser una alternativa als reactors de fissió nuclear actuals com a font denergia elèctrica. L'avantatge d'aquesta tecnologia és que produirà energia pràcticament il·limitada, ja que el deuteri i el triti es pot obtenir de l'hidrogen ordinari. Cal recordar que aquest element químic es troba en abundància a l'aire i l'aigua de mar.
Què és el triti?
El triti és un isòtop radioactiu de l'hidrogen el nucli del qual consisteix en un protó i dos neutrons. L'aplicació més important del triti és utilitzar-lo com a combustible nuclear per a l'obtenció d'energia mitjançant la fusió nuclear.
Se sol designar mitjançant el símbol T, encara que sistemàticament se li ha de simbolitzar com a 3H. Va ser descobert el 1934 per Rutherford, Oliphant i Harteck a l'estudi del bombardeig del deuteri amb deuterons.
El triti és un isòtop natural que es genera per l'acció dels raigs còsmics sobre els gasos atmosfèrics. D'altra banda, aquest isòtop es pot obtenir industrialment per bombardeig de liti amb neutrons de baixa energia.
El triti presenta una vida mitjana de 12,3 anys i emet radiació beta (β) de molt baixa energia (0,018 MeV), totalment lliure de radiació γ, per la qual cosa no presenta pràcticament radiotoxicitat.
Efectes del Triti sobre la salut
Les partícules beta formades per la reacció de descomposició del triti es propaguen a l'aire només 6,0 mm i ni tan sols poden superar la capa superior de la pell humana. Aquest isòtop, però, presenta un perill de radiació quan s'inhala, s'absorbeix amb els aliments i s'absorbeix a través de la pell.
Per què es fa servir el Triti?
El triti es pot utilitzar en diferents aplicacions amb diferents objectius:
-
Il·luminació autoalimentada: les partícules beta emeses per la desintegració radioactiva de petites quantitats de triti fan que brillin substàncies químiques anomenades fòsfors.
-
Armes nuclears: Aquest element químic s'utilitza per millorar l'eficiència i el rendiment de les bombes de fissió nuclear i les etapes de fissió de les bombes d'hidrogen en un procés conegut com a reforç.
-
Fusió nuclear controlada: el triti és un combustible important per a la fusió nuclear controlada en els dissenys de reactors nuclears de fusió per confinament magnètic i per inèrcia.
-
Química analítica: el triti de vegades s'usa com a radiomarcador. Té l'avantatge que gairebé tots els productes químics orgànics contenen hidrogen, per la qual cosa és fàcil trobar un lloc per col·locar triti a la molècula sota investigació.
Què és el deuteri?
El deuteri (²H) és un isòtop estable de l'hidrogen que es troba a la natura amb una proporció d'un de cada 6500 àtoms d'hidrogen. El nucli atòmic del deuteri està compost per un protó i un neutró.
El deuteri també se'l coneix per hidrogen pesat i es representa amb el símbol ²H o com a D. Encara que es tracta d'un àtom d'hidrogen, les propietats físiques entre el deuteri i un àtom d'hidrogen lleuger són màximes ja que la massa atòmica del deuteri és el doble.
La Terra i altres parts del sistema solar conté deuteri. La fusió estel·lar destrueix el deuteri i no hi ha processos de creació naturals coneguts a excepció de la nucleosíntesi primordial.
Per què serveix el Deuteri?
El deuteri és útil en els processos de fusió nuclear juntament amb el triti a causa de la gran secció eficaç de la reacció.
En química i bioquímica, el deuteri s'utilitza com a traçalínies isotòpic no radioactiu en molècules per estudiar reaccions químiques i canvis metabòlics, ja que químicament es comporta semblantment a l'hidrogen ordinari. Això no obstant, podem distingir-lo de l'hidrogen ordinari per la seva massa.
