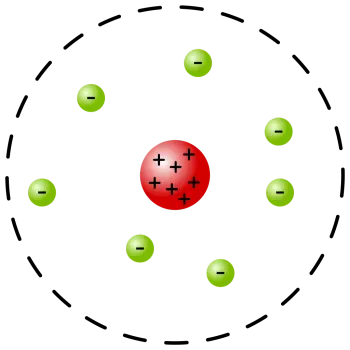
El model atòmic de Rutherford o model atòmic planetari és un model de l'àtom proposat per Ernest Rutherford.
El 1909 es va realitzar l'experiment de Geiger i Marsden, també conegut com l'experiment de Rutherford, ja que va ser dirigit pel propi Rutherford. Els resultats de l'experiment es van publicar en una anàlisi de 1911 per Rutherford. La dispersió de Rutherford observada en l'experiment va suggerir que els primers models atòmics "panettone" i "saturnià" eren incorrectes.
El nou model proposat per Rutherford tenia característiques que s'han mantingut fins i tot en models posteriors, com:
-
La concentració de la majoria de la matèria en un volum petit en comparació amb la mida atòmic, és a dir, un nucli atòmic
-
La presència d'electrons que giren al voltant de l'nucli atòmic.
Rutherford no va dir res sobre el possible moviment dels electrons, també perquè sabia que la seva revolució al voltant de l'nucli central provocaria l'emissió d'ones electromagnètiques.
No obstant això, a partir de la seva descripció, va començar a representar l'àtom amb el nucli al centre i els electrons en òrbita al voltant d'ell, com els planetes de sistema solar al voltant de Sol. A causa d'aquesta representació en particular se li va conèixer com a model planetari.
Quins són els punts fonamentals de el model de Rutherford?
-
L'àtom és majoritàriament un espai buit. Rutherford va negar el model atòmic de Thomson a l'confirmar l'existència d'el nucli atòmic, ja postulat per Nagaoka. No obstant això, Ruthenford va assenyalar que el nucli de l'àtom és molt petit en comparació amb el mateix àtom.
-
Al nucli de l'àtom es concentrava la massa i la càrrega positiva de l'àtom. Aquesta característica equilibrava la càrrega elèctrica dels electrons fent-ho elèctricament neutre. Rutherford va introduir el concepte de pes atòmic, que anteriorment s'havia omès. La càrrega nuclear va ser identificada com a responsable de la dispersió de partícules alfa.
-
Els electrons amb càrrega negativa presents al voltant de l'àtom no afecten la dispersió de les partícules alfa.
Com va ser l'experiment d'Ernest Rutherford?
El 1911 Rutherford va proposar el seu model d'estructura atòmica per a explicar els resultats de l'experiment anterior de Geiger i Marsden, que indicava la presència d'una concentració de càrrega positiva en el centre de l'àtom: el nucli atòmic.
No obstant això, en el seu treball, Rutherford va proposar fer passar una partícula α d'alta velocitat a través d'un àtom d'una làmina d'or que té una càrrega central positiva estant envoltat per una càrrega de la mateixa magnitud d'electrons.
A partir de consideracions energètiques, Rutherford va deduir que el radi de la càrrega central dels àtoms d'un sèrie de làmines primes d'or, que van ser l'objectiu de la radiació en l'experiment de Geiger i Marsden, ha d'haver estat menor que 3,4 x 10-14 m. D'altra banda, el radi atòmic de l'or era se sap que és de l'ordre de 10-10 m.
Rutherford va concloure que, per tant, la càrrega ha de concentrar-se en un volum molt petit en relació amb la mida atòmic. El 1913 Henry Moseley va demostrar que la càrrega nuclear era molt similar a el nombre atòmic i més tard Antonius van den Broek va suggerir que el nombre atòmic corresponia a la càrrega nuclear.
Rutherford no va atribuir cap estructura a les òrbites dels electrons, però, va esmentar el model atòmic de Hantaro Nagaoka, en el qual els electrons estaven disposats en anells, el que demostra que no serien estables.
