El 1904, Joseph John Thomson va proposar una evolució del model atòmic de Dalton, donant lloc al famós model de Thomson, una teoria revolucionària que va intentar explicar dues propietats fonamentals dels àtoms en aquell moment.
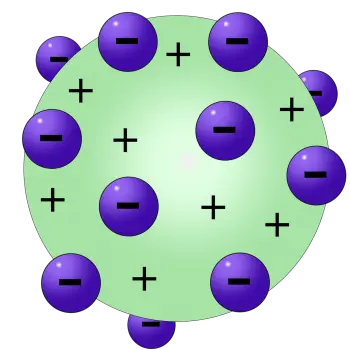
En aquest model, Thomson va postular que els electrons, partícules amb càrrega negativa, estaven dispersos en un fons de càrrega positiva, creant una estructura que s'assemblava a unes postres britànices conegudes com el "pudí de panses". Aquest sobrenom curiós prové de l'analogia visual dels electrons (les "passes") dispersos en un fons positiu (el "pudí").
Aquesta nova teoria atòmica de Thomson va intentar explicar dues propietats llavors conegudes dels àtoms:
- Els electrons són partícules carregades negativament.
- Els àtoms no tenen càrrega elèctrica neutra.
Postulats de Thomson
El model atòmic de JJ Thomson, va introduir diversos postulats clau que buscaven explicar les propietats observades dels àtoms en aquell moment. Aquí hi ha els postulats fonamentals i les seves característiques:
- Electrons com a partícules subatòmiques: Thomson va postular l'existència de partícules subatòmiques amb càrrega negativa, que més tard es van identificar com a electrons. Aquest va ser un avenç important, ja que fins aquell moment, els àtoms es consideraven indivisibles segons el model atòmic de Dalton.
- Estructura esfèrica de l'àtom: Thomson va imaginar l'àtom com una esfera uniforme de càrrega positiva, on els electrons, de càrrega negativa, estaven incrustats com panses en un púding. Aquest concepte d‟estructura esfèrica contrastava amb la idea anterior d‟àtoms indivisibles de Dalton.
- Distribució uniforme d'electrons: Segons el model de Thomson, els electrons estaven distribuïts de manera uniforme a tota l'esfera carregada positivament. Aquesta disposició cercava explicar la neutralitat elèctrica de l'àtom en conjunt.
- Moviment lliure d'electrons: Segons aquest postulat, els electrons es consideraven capaços de moure's lliurement dins de l'esfera carregada positivament, cosa que explicava l'estabilitat de l'àtom. Thomson va suggerir que les forces d'atracció entre els electrons i la càrrega positiva circumdant eren responsables de mantenir els electrons a les seves òrbites.
- Explicació dels espectres de línia: Thomson va proposar que els electrons giraven lliurement en òrbites anulars dins de l'àtom. Les diferències en les energies d'aquests nivells orbitals explicarien els espectres de línia observats a l'emissió de llum quan els electrons saltaven entre aquestes òrbites.
Per què es coneix com el model del púding de panses?
 El model de Thomson ha estat comunament comparat amb les postres britànices conegudes com a púding de panses, la qual cosa li va valer el seu nom característic. Encara que Thomson no ho va descriure així, l'analogia va ser adoptada per altres per il·lustrar millor la seva idea.
El model de Thomson ha estat comunament comparat amb les postres britànices conegudes com a púding de panses, la qual cosa li va valer el seu nom característic. Encara que Thomson no ho va descriure així, l'analogia va ser adoptada per altres per il·lustrar millor la seva idea.
En aquest model, els electrons -carregats negativament- estan distribuïts com si fossin "passes" incrustades dins d'una massa de càrrega positiva, que representa el "pudí". D'aquesta manera, la càrrega positiva equilibra la càrrega negativa dels electrons, mantenint l'àtom en conjunt elèctricament neutre. Aquesta representació senzilla, encara que avui és obsoleta, va ajudar a visualitzar com podrien coexistir les partícules subatòmiques en un espai relativament petit, abans que es coneguessin detalls més precisos sobre l'estructura de l'àtom.
Característiques del model atòmic de Thomson
Segons el model atòmic de Thomson, l'àtom consisteix en electrons col·locats en una sopa carregada positivament, que compensa les càrregues elèctricament negatives dels electrons.
Segons aquest model, els electrons podrien girar lliurement en una gota o un núvol d'una substància tan carregada positivament. Les seves òrbites es van estabilitzar dins de l'àtom pel fet que quan un electró s'allunya del centre d'un núvol carregat positivament experimenta un augment en la força d'atracció cap al centre del núvol.
Aquesta força d'atracció el torna a tornar al centre. La força d'atracció al centre d'un núvol esfèric carregat uniformement és directament proporcional a la distància al centre.
Al model de Thomson, els electrons poden rotar lliurement en òrbites d'anells, que s'estabilitzen mitjançant interaccions entre electrons. Els espectres de línia eren explicats per la diferència d'energies quan es movien al llarg de diferents òrbites d'anells.
El model de Thomson es va convertir en un precursor del posterior model atòmic de Bohr, que representa l'àtom com una semblança del sistema solar .
Limitacions del model
El model de l'àtom de Thomson va ser refutat en un experiment sobre la dispersió de partícules alfa en una làmina d'or el 1909, que va ser analitzat per Ernest Rutherford el 1911. L'experiment de Rutherford suggeria que l'àtom tenia un nucli molt petit que conté una gran càrrega positiva.
El 1913, Henry Moseley va demostrar experimentalment que la càrrega nuclear en càrregues elementals està molt a prop del nombre atòmic.
Aquest treball finalment va conduir a la creació el mateix any del model de Bohr, similar al sistema solar. Segons aquest model, el nucli té una càrrega positiva igual al nombre atòmic i està envoltat per un nombre igual delectrons en capes orbitals.
El problema de Thomson
En considerar el model de Thomson, es va formular un problema de física matemàtica encara sense resoldre - trobar la configuració de moltes càrregues amb lenergia potencial més baixa en una esfera - el problema de Thomson.
Llegat de Thomson
El llegat de JJ Thomson a la física i la química és innegable, no només pel descobriment de l'electró, sinó també per haver revolucionat la manera com concebem els àtoms. Encara que el model del "pudí de panses" va ser eventualment reemplaçat, va representar un pas crucial cap a la comprensió moderna de la matèria. Thomson va desafiar la noció que els àtoms eren indivisibles amb els seus postulats i va obrir les portes a una era de recerca subatòmica.
Al meu entendre, el més admirable del treball de Thomson és la seva capacitat per veure més enllà de les idees acceptades i proposar una cosa completament nova, cosa que requereix una notable valentia intel·lectual. El seu model, encara que senzill comparat amb els avenços posteriors, va ser clau en el desenvolupament de la física moderna. És un recordatori que cada teoria, fins i tot si es perfecciona o es descarta amb el temps, pot ser l'espurna que impulsi el gran avenç científic següent.
En aquest sentit, el llegat de Thomson no rau només en el seu model atòmic, sinó en la seva capacitat per qüestionar allò establert i promoure una nova forma de pensar sobre la naturalesa de la matèria. Sense la seva feina, la comprensió actual de l'àtom no hauria estat possible.
