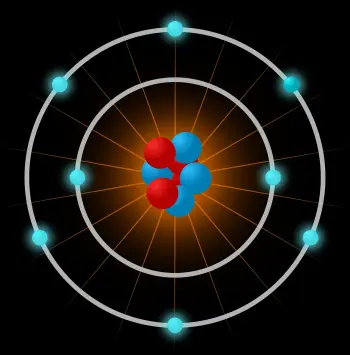
Un àtom és la unitat constituent més petita de la matèria ordinària que té les propietats d'un element químic. L'àtom està compost per:
-
El nucli atòmic: format per unes partícules subatòmiques anomenades nucleons. Els nucleons poden ser neutrons o protons.
-
Un núvol d'electrons: un altre tipus de partícula subatòmica movent-se al voltant de l'nucli.
La principal diferència entre protons, neutrons i electrons és la seva càrrega elèctrica. Els electrons tenen càrrega elèctrica negativa, els protons tenen càrrega positiva i els neutrons són partícules amb càrrega elèctrica neutra.
Els àtoms neutres tenen el mateix nombre d'electrons que de protons ja que ambdues subpartícules tenen la mateixa càrrega elèctrica.
Un àtom està constituït per un nucli central molt dens, amb els nucleons molt junts, i per electrons que es mouen al voltant de l'nucli a una distància relativament gran.
Estructura de l'nucli de l'àtom
El nucli atòmic és la part central de l'àtom que està compost per nucleons units entre ells per uns enllaços molt forts. Un nucleó pot ser un protó o un neutró.
A causa que els protons tenen una càrrega elèctrica positiva i els neutrons tenen càrrega neutra, la tendència natural és la de separar-se. Els enllaços que mantenen units els nucleons exerceixen una força nuclear molt més intensa que la força electromagnètica a distàncies curtes.
La força d'aquests enllaços nuclears permet vèncer la repulsió elèctrica entre els protons.
Què és el nombre màssic d'un àtom?
El nombre màssic d'un àtom és el nombre de nucleons del seu nucli atòmic, és a dir, la suma de protons i neutrons.
El volum de l'nucli és aproximadament proporcional a el nombre total de nucleons, el nombre màssic.
Què representa el nombre atòmic?
El nombre atòmic és el nombre de protons que té un àtom i es representa per Z.
Els àtoms es classifiquen en la taula periòdica dels elements segons el nombre atòmic.
Isòtops: àtoms amb una composició de l'nucli diferent
Els àtoms d'un element químic han de tenir la mateixa quantitat de protons, però poden tenir un nombre diferent de neutrons. Es diuen isòtops els àtoms d'un mateix element amb diferent nombre de neutrons.
Els isòtops es poden trobar en forma natural però també es poden manipular. Per exemple, l'enriquiment d'urani consisteix a incrementar el nombre de neutrons d'un àtom d'urani perquè sigui més inestable i afavorir les reaccions de fissió.
Què és el núvol d'electrons?
L'electró és una partícula elemental estable amb la càrrega negativa més petita que existeix en la natura. Aquesta càrrega es denomina càrrega elemental, ja que qualsevol càrrega elèctrica separable es compon d'un nombre enter d'elles.
Els electrons tenen càrrega elèctrica negativa, per tant són atrets pels protons, de signe positiu en l'àtom a través de la força electromagnètica. Aquesta força augmenta a l'reduir la distància entre l'electró i el nucli.
L'existència d'l'electró la va descobrir JJ Thomson. A partir d'aquest moment ja va aparèixer en tots els models atòmics desenvolupats en el futur.
Orbitals atòmics: la probabilitat de trobar un electró en un punt
Els electrons tendeixen a formar un cert tipus d'ona estacionària al voltant de l'nucli atòmic. Cadascuna d'aquestes ones està caracteritzada per un orbital atòmic, una funció matemàtica que descriu la probabilitat de trobar a l'electró en cada punt de l'espai.
El núvol d'electrons és la regió ocupada per aquestes ones, visualitzada com una densitat de càrrega negativa al voltant de l'nucli.
Cada orbital correspon a un possible valor d'energia per als electrons. No obstant això, un electró pot saltar a un nivell superior oa un nivell inferior captant o emetent energia.
El concepte d'orbital atòmic es va introduir per primera vegada en el model atòmic de Schrödinger.
Quina importància té la composició d'un àtom amb l'energia nuclear?
La base de tot el relacionat amb l'energia nuclear rau en el nucli de l'àtom, ja que la tecnologia nuclear es basa en l'aprofitament de l'energia interna continguda en els àtoms.
L'energia nuclear s'obté a partir de la divisió de el nucli d'un àtom (fissió nuclear) o de la fusió de dos nuclis atòmics (fusió nuclear).
Quan això passa i l'estructura de l'àtom varia s'allibera una gran quantitat d'energia tèrmica.
Reaccions nuclears: fissió i fusió d'àtoms
El nucli atòmic es pot veure alterat per processos molt energètics que poden provocar un canvi en l'estructura de l'àtom. Els nuclis inestables d'urani i plutoni poden patir desintegracions que poden canviar el nombre de protons i neutrons emetent radiació.
Un nucli pesat pot fisionarse en altres més lleugers en una reacció nuclear o espontàniament. Mitjançant una quantitat suficient d'energia, dos o més nuclis poden fusionar-se en un altre més pesat, en aquest cas, es tractaria d'una reacció de fusió nuclear.
Els elements químics que tenen un nombre atòmic baix, els nuclis amb diferent nombre de protons i neutrons tendeixen a desintegrar-se en nuclis amb proporcions més semblants. No obstant això, els elements més pesats necessiten una proporció de neutrons més gran per estabilitzar el nucli.
