La taula periòdica d'elements és una taula que conté representats tots els elements químics coneguts.
Durant el segle XIX, els químics van començar a classificar els elements químics que es coneixien segons les seves propietats físiques i químiques. El 1860 es va organitzar el primer Congrés Internacional de Químics a la ciutat alemanya de Karlsruhe amb l'objectiu d'unificar el criteri per a la classificació dels elements. Aquesta reunió va ser crucial en la història de la ciència i l'origen de la creació de la taula que avui dia apareix en els llibres de text.
D'acord amb la Unió Internacional de Química Pura i Aplicada (IUPAC) la taula periòdica dels elements químics néixer l'1 de març de 1869.
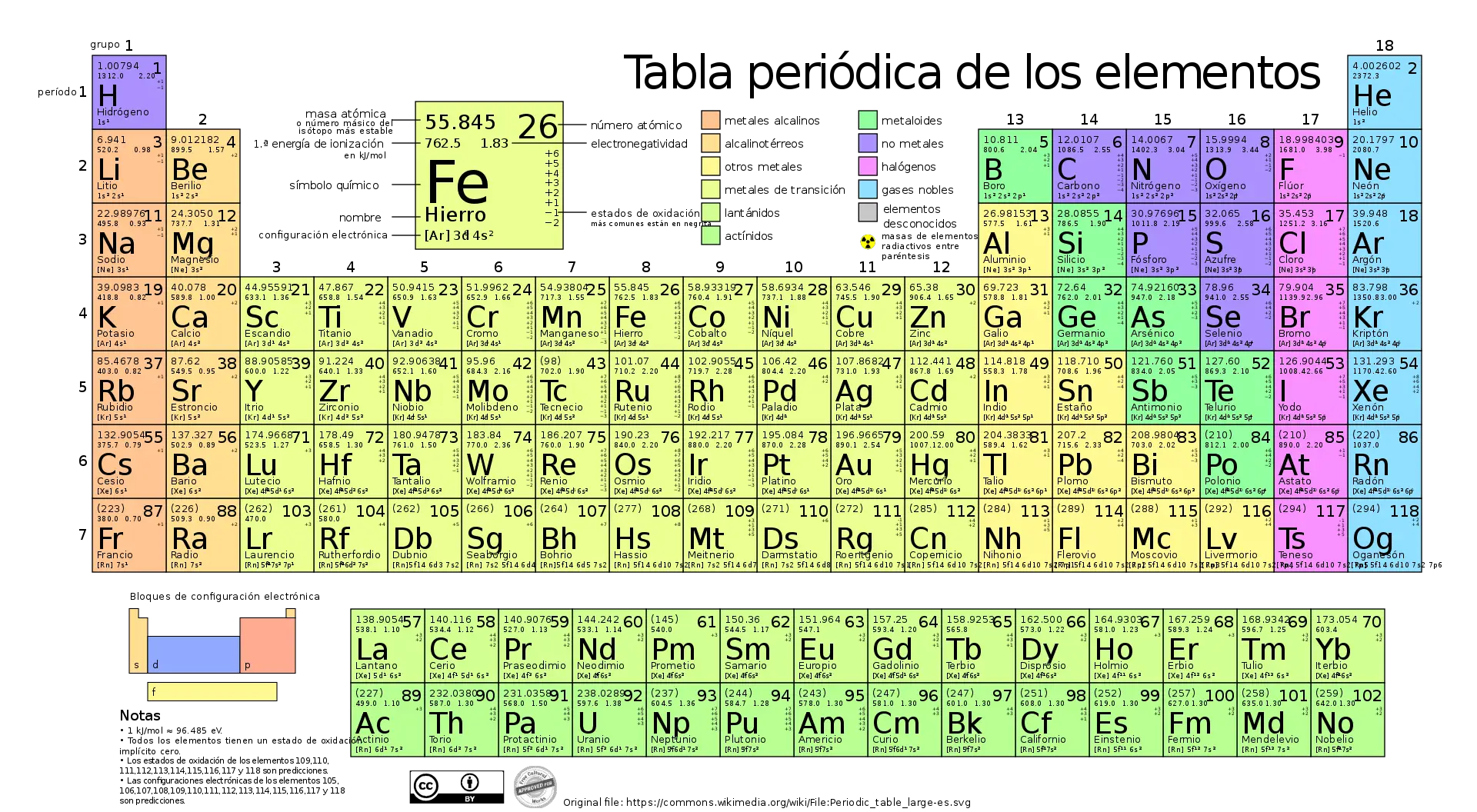
Quants elements químics conté la taula periòdica?
Actualment la taula periòdica conté 118 elements químics.
Els últims elements que es van introduir en la taula periòdica són els elements 113, 115, 117 i 118. Els noms d'aquests nous elements són Nihonio, Moscovio, Téneso i Oganesón, respectivament. Aquesta incorporació es va realitzar l'1 de desembre de 2016.
Com estan ordenats els elements químics a la taula periòdica?
Dins de la taula periòdica dels elements químics estan ordenats segons els seus números atòmics, és a dir, el nombre de protons en el nucli de l'àtom.
La taula periòdica està organitzada en files i columnes. Les columnes s'anomenen grups, mentre que les files es coneixen com a períodes.
Els elements es col·loquen de manera que els elements amb configuracions electròniques similars estan una a sobre de l'altra. També està ordenat perquè els elements amb comportaments similars estiguin en la mateixa columna.
Per a què serveix la taula periòdica?
La taula periòdica té múltiples utilitats en química i en altres ciències. Les més importants són:
-
Mostrar les relacions entre els diferents elements químics.
-
Predir les propietats d'elements recentment descoberts o que encara no s'han sintetitzat.
-
Proporciona una imatge útil a l'analitzar els comportaments químics de les substàncies químiques.
Períodes de la taula periòdica
Un període de la taula periòdica correspon a una fila horitzontal. Normalment les tendències periòdiques més clares s'aprecien en els grups, però, hi ha certes regions de la taula en què les tendències en el sentit horitzontal són més destacades.
Els elements de el mateix període de la taula mostren tendències en el potencial d'ionització, el radi atòmic i l'afinitat electrònica i electronegativitat.
D'esquerra a dreta en un període, el radi atòmic generalment disminueix. Això es deu al fet que en aquesta direcció cada element de la taula té un electró i un protó extra, i els electrons s'aproximen a l'nucli. Aquesta disminució de el radi atòmic assegura que en un període el potencial d'ionització també augmentarà d'esquerra a dreta.
La electronegativitat creix a l'igual que ho fa el potencial d'ionització. Aquest augment es deu al fet que el nucli atrau els electrons.
Grups o famílies de la taula periòdica
Un grup o família és una columna de la taula periòdica dels elements químics. Habitualment, els grups tenen tendències periòdiques més destacades que els blocs i períodes.
Els elements químics que pertanyen a mateix grup presenten propietats químiques similars. A més hi ha una clara tendència a augmentar dels nombres atòmics. Però en algunes parts de la taula les similituds horitzontals i verticals poden ser igual d'importants.
Propietats dels elements dins de el grup
Els elements de el mateix grup tendeixen a exhibir patrons de ràdio atòmic, potencial d'ionització i electronegativitat. De dalt a baix, el radi atòmic dels elements augmentarà per grup, ja que hi ha més electrons i els electrons de valència estaran més allunyats de l'nucli de l'àtom.
Des de la part de dalt, cada element químic té un potencial d'ionització més feble. Això es deu al fet que resulta més senzill eliminar un electró ja que la força amb la qual estan units els àtoms és més feble.
L'electronegativitat de les famílies en general es redueix a l'baixar a la taula. Aquesta baixada es deu a l'augment de la distància entre el nucli i els electrons de valència.
Blocs de la taula periòdica
Els blocs són les regions específiques de la taula periòdica dels elements. El nom de bloc correspon a el de la capa que conté l'últim electró.
A la taula periòdica hi ha els següents blocs:
-
El bloc "s": engloba el primer i el segon grup que correspon a l'hidrogen, l'heli, els metalls alcalins i metalls alcalinoterris.
-
El bloc "p" inclou els últims sis grups. Entre d'altres elements, inclou els gasos nobles i els metal·loides.
-
El bloc "d" inclou els grups compresos entre el 3 i el 12. Aquest bloc conté tots els metalls de transició.
-
El bloc "f" no té números de grup. Freqüentment es representa sota de la resta de la taula. El bloc "f" els actínids i els lantànids.
A qui se li atribueix la taula periòdica?
La primera taula periòdica recognoscible va ser publicada pel químic rus Dmitri Mendeléiev el 1869 en una obra anomenada "Principis de química". La forma en què avui organitzem els elements químics segueix encara la proposta de Mendeléiev.
 A el mateix moment, el químic alemany Julius Lothar Meyer, contemporani competidor de Mendeléiev, també va treballar amb la idea de crear la primera taula periòdica. Meyer va ordenar els elements a partir de les propietats físiques dels àtoms però la seva proposta no va tenir tanta acceptació.
A el mateix moment, el químic alemany Julius Lothar Meyer, contemporani competidor de Mendeléiev, també va treballar amb la idea de crear la primera taula periòdica. Meyer va ordenar els elements a partir de les propietats físiques dels àtoms però la seva proposta no va tenir tanta acceptació.
Des de la seva creació, la taula periòdica dels elements de Mendeleev s'ha completat i ampliat a mesura que s'han descobert o sintetitzat altres elements.
No obstant això, alguns científics opinen que la versió definitiva de la taula es va aconseguir gràcies a la llei periòdica presentada al començament de segle XX per Henry Moseley.
Les prediccions de Dmitri Mendeléiev
Mendeléiev va desenvolupar la seva taula per mostrar tendències periòdiques en els 63 elements químics que es coneixien en aquell moment. També va predir algunes propietats de substàncies químiques que en aquell moment es desconeixien però que esperava omplirien els buits a la taula.
Quan es van descobrir aquests nous elements, les seves prediccions van resultar ser en gran part correctes.
