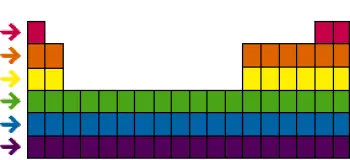
La taula periòdica dels elements és una de les eines més poderoses i fonamentals a la química. A més de les famílies o grups, la taula periòdica també s'organitza en “períodes” o “files” horitzontals.
Els períodes tenen una importància significativa en la comprensió de la química dels elements, ja que representen una disposició ordenada dels electrons a les capes electròniques dels àtoms.
L'estructura d'un període
Cada període de la taula periòdica representa una capa electrònica addicional als àtoms dels elements a mesura que avancem d'esquerra a dreta a la taula. Començant des del primer període a la part superior, que conté només dos elements (hidrogen i heli), els elements a cada període tenen el mateix nombre de capes electròniques.
Exemples
Per exemple, en el segon període, els elements com el liti, el beril·li, el bor, el carboni, el nitrogen, l'oxigen, el fluor i el neó, tots tenen dues capes electròniques als seus àtoms.
Al tercer període, els elements com el sodi, el magnesi, l'alumini, el silici, el fòsfor, el sofre, el clor i l'argó tenen tres capes electròniques, i així successivament a mesura que avancem a períodes més baixos.
Propietats dels elements en un període
Els elements dins un mateix període tenen propietats químiques i físiques que segueixen certs patrons i tendències:
Grandària atòmica

Això és degut a que a mesura que s'agreguen protons i electrons a la mateixa capa electrònica, la càrrega nuclear efectiva augmenta, la qual cosa atrau més fortament els electrons cap al nucli, reduint la mida de l'àtom.
Electronegativitat
L'electronegativitat, que mesura la tendència d'un àtom a atreure electrons compartits en un enllaç químic, tendeix a augmentar a mesura que avancem d'esquerra a dreta en un període.
Els elements a la part dreta dun període són més electronegatius que els de lesquerra.
Reactivitat
Els elements a la mateixa columna de la taula periòdica (en el mateix grup o família) tendeixen a tenir propietats químiques similars pel fet que tenen la mateixa quantitat d'electrons a la seva capa de valència.
Tot i això, en un període, a mesura que avancem d'esquerra a dreta, els elements tendeixen a tornar-se menys metàl·lics i més no metàl·lics en el seu comportament químic.
Per exemple, els metalls alcalins al Grup 1 són altament reactius, mentre que els elements a la part dreta d'un període, com el fluor i l'oxigen, són no metalls i tendeixen a formar compostos covalents.
Energia d'Ionització
Lenergia dionització, que és lenergia requerida per eliminar un electró dun àtom, generalment augmenta a mesura que avancem desquerra a dreta en un període.
Els elements a la part dreta d'un període tenen energies d'ionització més altes, cosa que vol dir que és més difícil eliminar un electró dels seus àtoms.
Importància dels períodes
 Els períodes a la taula periòdica són fonamentals per comprendre com l'estructura electrònica dels àtoms influeix en el seu comportament químic. En observar les tendències en les propietats dels elements durant un període, els químics poden predir com els àtoms interactuaran i formaran compostos químics.
Els períodes a la taula periòdica són fonamentals per comprendre com l'estructura electrònica dels àtoms influeix en el seu comportament químic. En observar les tendències en les propietats dels elements durant un període, els químics poden predir com els àtoms interactuaran i formaran compostos químics.
A més, la informació sobre els períodes també és valuosa a la química inorgànica ia la síntesi de compostos.
Per exemple, quan es cerca sintetitzar un nou compost químic, conèixer les propietats dels elements en el mateix període pot ajudar els científics a seleccionar els elements apropiats perquè reaccionin de la manera desitjada.
Conclusió
Els períodes de la taula periòdica són una part essencial de la seva organització i tenen un paper crucial en la comprensió de la química dels elements.
A mesura que avancem d'esquerra a dreta en un període, podem observar com les propietats i el comportament dels elements canvien de manera sistemàtica a causa de l'addició de capes electròniques i la variació a la càrrega nuclear efectiva.
Aquesta organització ordenada dels elements en períodes és un recordatori de la relació profunda entre l'estructura electrònica dels àtoms i la seva química subjacent.
