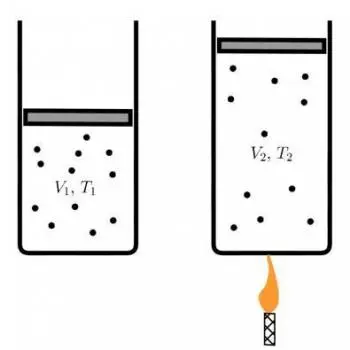
La llei de Charles, també coneguda com a llei dels volums, és un dels principis fonamentals en la termodinàmica dels gasos.
Aquesta llei, nomenada en honor al científic francès Jacques Charles, estableix una relació crucial entre el volum d'un gas i la temperatura en graus Celsius (°C) a pressió constant.
Formula de la llei de Charles
La formulació de la llei de Charles respon a la següent equació:
V1 / T1=V2 / T2
On:
- V 1 és el volum inicial del gas.
- T 1 és la temperatura inicial en graus Celsius (°C).
- V 2 és el volum final del gas.
- T 2 és la temperatura final en graus Celsius (°C).
Aquesta equació estableix que la relació entre el volum i la temperatura dun gas, a pressió constant, és una relació directament proporcional. Quan la temperatura augmenta, el volum també augmenta, i quan la temperatura disminueix, el volum del gas disminueix, sempre que la pressió es mantingui constant.
Història i context de la llei
 La Llei de Charles és el resultat dels avenços en la comprensió dels gasos que van tenir lloc al segle XVIII. Abans de formular aquesta llei, científics com Robert Boyle havien establert la llei de Boyle-Mariotte, que descriu la relació entre el volum i la pressió d'un gas a temperatura constant.
La Llei de Charles és el resultat dels avenços en la comprensió dels gasos que van tenir lloc al segle XVIII. Abans de formular aquesta llei, científics com Robert Boyle havien establert la llei de Boyle-Mariotte, que descriu la relació entre el volum i la pressió d'un gas a temperatura constant.
A la mateixa època, Joseph Black havia observat que la temperatura estava relacionada amb el volum d'un gas, encara que no havia formulat una llei específica per a aquesta relació.
El treball de Jacques Charles, un científic francès, va ser essencial per consolidar aquesta relació. El 1787, Charles va realitzar una sèrie d'experiments que el van portar a la formulació de la seva llei.
La seva observació fonamental va ser que, a pressió constant, el volum d'un gas augmenta de manera proporcional a la temperatura en graus Celsius. Això vol dir que, si la temperatura d'un gas es duplica, el volum també es duplica, sempre que la pressió es mantingui constant.
Importància a la termodinàmica de gasos
La llei de Charles és fonamental en la termodinàmica de gasos i té diverses implicacions importants de les quals en destaquem dues:
-
Equació dels gasos ideals: La Llei de Charles és una de les equacions que conformen l'equació general dels gasos ideals. Aquesta equació, PV=nRT, relaciona la pressió (P), el volum (V), la quantitat de substància (n) i la temperatura (T) d'un gas ideal. La relació entre el volum i la temperatura de pressió constant és un component clau d'aquesta equació.
-
Comportament dels gasos: La llei ajuda a comprendre com els gasos es comporten en resposta als canvis de temperatura. Aquesta comprensió és essencial en diverses aplicacions, com ara la producció d'energia, la química industrial i l'enginyeria.
Exemples d'aplicacions pràctiques
 La llei de Charles té una àmplia gamma d'aplicacions pràctiques a la vida quotidiana ia diverses indústries.
La llei de Charles té una àmplia gamma d'aplicacions pràctiques a la vida quotidiana ia diverses indústries.
Alguns exemples d'aquestes aplicacions inclouen:
-
Refrigeració i aire condicionat: Els sistemes de refrigeració i aire condicionat es basen en el principi que en comprimir un gas, la seva temperatura augmenta, i en expandir-lo, la seva temperatura disminueix. Això permet la regulació de la temperatura en espais tancats.
-
Globus aerostàtics: Els globus aerostàtics s'omplen amb aire calent. Quan s'escalfa l'aire al globus, el seu volum augmenta, cosa que li permet elevar-se d'acord amb el principi d'Arquimedes. Precisament Jacques Charles va batre un rècord de vol amb globus aerostàtic.
-
Processos de fabricació: A la indústria, s'utilitzen forns i reactors com els que s'utilitzen a les centrals nuclears que involucren vapor d'aigua i altres gasos. La comprensió de la relació entre el volum i la temperatura és essencial per a la producció de productes químics, metalls i altres materials.
-
Seguretat a la indústria: La llei de Charles també és important en la seguretat industrial. Comprendre com els canvis de temperatura afecten el volum dels gasos és fonamental per evitar situacions perilloses en plantes químiques i processos industrials.
Conclusió
La llei de Charles, formulada per Jacques Charles al segle XVIII, exerceix un paper crucial en la termodinàmica de gasos. Aquesta llei estableix una relació directament proporcional entre el volum i la temperatura dun gas a pressió constant.
La importància es reflecteix en una àmplia gamma d'aplicacions pràctiques, des de sistemes de refrigeració i calefacció fins a la producció industrial i la seguretat en la manipulació de gasos.
L'obra de Charles és un testimoni de la importància de les lleis fonamentals en la comprensió i l'aplicació de principis científics a la vida quotidiana ia diverses indústries.
