Un protó és una partícula subatòmica amb càrrega elèctrica positiva que es troba dins del nucli atòmic dels àtoms. El nombre de protons al nucli atòmic és el que determina el nombre atòmic d'un element que s'indica a la taula periòdica dels elements.
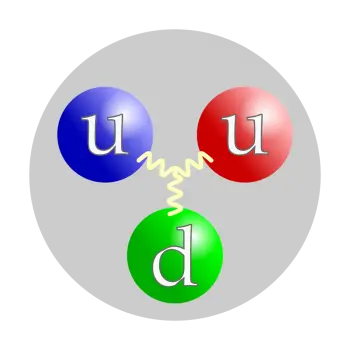
El protó no és una partícula elemental sinó una partícula composta. Està format per tres partícules unides per gluons, dos quarks a dalt i un quark a baix. Aquesta estructura significa que és un barió (un subtipus de les partícules anomenades hadrons).
Aquestes subpartícules atòmiques són presents als nuclis atòmics, generalment units als neutrons per una força nuclear forta. Com que és una de les partícules subatòmiques que formen part del nucli és un nucleó. L'única excepció en què forma un nucli atòmic sense cap neutró és el nucli de l'hidrogen ordinari.
Poden existir protons lliures en plasmes (el quart estat d'agregació de la matèria), raigs còsmics i el vent solar (corrent de partícules carregades alliberades des de l'atmosfera solar).
La vida d'un protó és aproximadament de 1035 anys, per això es considera eterna a nivell experimental. Des del punt de vista del model estàndard de la física de partícules són partícules estables. Les lleis de la física no permeten que un nucleó es descomposi espontàniament a causa de la preservació del nombre de barions.
Quina és la massa d'un protó?
Un protó té una massa de prop de 1.674 x 10-24 g.
Aquest valor és aproximadament la mateixa massa que els neutrons. En comparació amb l'electró, la massa del protó és aproximadament 1,836 vegades més gran.
Quina és la càrrega elèctrica de protó?
El protó té una càrrega elemental positiva de 1,602 x 10-19 coulombs. Exactament la mateixa càrrega absoluta que l'electró però de signe contrari.
Per què són importants els protons?
Els protons són importants perquè defineixen quin element és un àtom.
El nombre atòmic (Z) d'un àtom és el nombre de protons al nucli i determina les propietats químiques de l'àtom.
Per determinar els isòtops d'un element, també s'utilitza el nombre de neutrons (N) sumant tots els nucleons, i es coneix com a número màssic (A).
Una altra característica important és que la càrrega positiva contribueix a captar electrons i mantenir-los orbitant al voltant del nucli de l'àtom.
Qui va descobrir el protó?
El protó va ser descobert per Ernest Rutherford l'any 1919.

La història del seu descobriment es remunta al 1886, quan Eugene Goldstein va descobrir els raigs anòdics i va demostrar que eren partícules amb càrrega positiva (ions) produïts a partir dels gasos.
Amb els seus experiments, Goldstein va observar que aquestes partícules tenien valors diferents de relació entre càrrega i massa. Per això no es va poder identificar la càrrega positiva amb una partícula.
El 1911, Ernest Rutherford va presentar el seu model atòmic planetari. En aquest model ja establia que al centre de l'àtom es concentrava una càrrega elèctrica positiva envoltada dels electrons descoberts per Thompson amb càrrega negativa.
Rutherford va alliberar el nucli de l'hidrogen usant una font de radioactivitat per produir partícules alfa energètiques. Amb les seves investigacions, Rutherford va demostrar que el nucli d'hidrogen era present a altres nuclis.
L'hidrogen és l'únic element de la taula periòdica que té un únic protó, per tant, quan feia referència a un nucli d'hidrogen era com parlar d'un protó.


